细胞微管是由极性微管蛋白组装而成的线性管状聚合物,作为细胞骨架的重要组成部分广泛存在于真核细胞中。由于随机的聚合和解聚过程,微管长度在增长和快速缩短两种状态间频繁切换,表现出强烈的动态不稳定性。这有利于微管在细胞内快速重构,从而积极参与细胞迁移、有丝分裂以及马达输运等众多重要细胞功能。现有理论认为微管蛋白水解发生构型变化引发的本征弯曲导致微管开裂并快速缩短,而微管在未水解微管蛋白处止裂并重新生长。目前的微管动力学研究,理论上多采用简化一维模型,数值上仅考虑静态力学作用的三维粗粒化模型,而对微管三维弹性壳结构、生长端特征复杂形貌、以及裂纹间相互作用等多种关键因素对生长动力学的影响缺乏认识。
近期,中国科学技术大学工程科学学院近代力学系梁海弋课题组和哈佛大学保尔森工程与应用科学学院 Mahadevan课题组合作,提出一种同时考虑力学和动力学的新型微管粗粒化模型,并结合理论系统研究了微管的动态组装过程,以崭新的视角揭示了微管三维空间结构、蛋白生长动力学、以及无序的未水解蛋白对动态不稳定性的关键影响。相关研究成果以“Mechanics and kinetics of dynamic instability”为题发表于国际著名学术期刊《eLife》(eLife 2020;9:e54077, DOI: 10.7554/eLife.54077)。
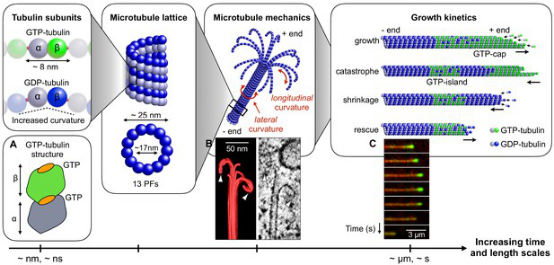
图1 考虑弹性力学作用和微管蛋白生长动力学的微管粗粒化模型
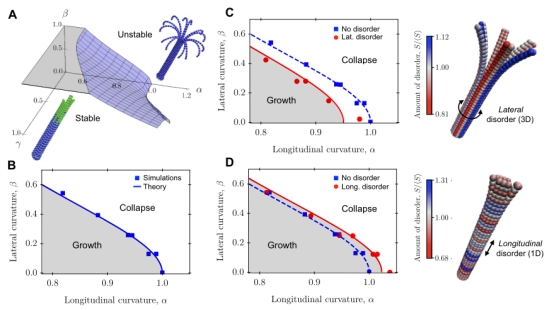
图2 微管的稳定性受双向本征曲率及未水解蛋白分布的影响
微管蛋白水解前后的构型变化是驱动微管发生开裂的主要原因。微管蛋白在水解前后的自然弯曲角度存在着差异,在力学上表现为不同的纵向本征曲率,同时微管蛋白共有的侧向本征曲率保证了微管的圆筒状结构。微管蛋白在两个方向上的本征曲率共同导致了微管的结构在力学上具有双稳定性。研究者通过建立基于粘附位点的三维粗粒化微管蛋白模型,成功再现了微管蛋白的拉伸、弯曲及双向本征曲率等特性。进一步,通过理论分析和改变微管蛋白的本征曲率、分布形式等几何参数以及生长速率、水解速率等动力学参数,研究者们统计得到了微管的临界开裂条件、不同条件下的开裂相图、以及不同未水解蛋白分布下的阻止开裂概率,完整地实现了对微管生长、开裂、停止开裂、再生长的全过程分析及模拟。这一研究系统地阐述了微管动力学不稳定性的力学机制,为系统研究生物大分子聚合物的行为提供了有效的模型和分析手段。
附文章链接:https://doi.org/10.7554/eLife.54077
